“Todos los años vemos alrededor de 300 nuevos pacientes con glioblastoma”, dijo el Dr. John de Groot, profesor y director provisional del Departamento de Neurooncología. “Tenemos algunos estudios de inmunoterapia muy estimulantes para estos pacientes”.
Desafíos y oportunidades
El glioblastoma tiene varias características que representan obstáculos para los profesionales clínicos y los investigadores. “Algunos tumores, tales como el cáncer de pulmón o el melanoma, tienen altas cargas mutacionales, lo cual da lugar a una larga lista de antígenos que pueden ser blanco de tratamiento. Sin embargo, esto no ocurre en el caso del glioblastoma”, dijo la Dra. Amy Heimberger, profesora del Departamento de Neurocirugía. En una escala del número de mutaciones dentro de diversos tipos de cáncer, dijo la Dra. Heimberger, el glioblastoma se ubica en el rango medio.
Junto con un número limitado de mutaciones, la heterogeneidad tumoral es un rasgo distintivo del glioblastoma. Por consiguiente, existen pocos blancos y no todos los pacientes desarrollan los mismos blancos. “Dado que estos tumores son heterogéneos, no se logrará que un fármaco cure a la mayor parte de los pacientes”, dijo la Dra. Heimberger.
Por último, la barrera hematoencefálica plantea un desafío para el tratamiento del glioblastoma y alguna vez se pensó que ella impedía que los inmunocitos del torrente sanguíneo llegaran al cerebro. Sin embargo, la investigación desarrollada en el MD Anderson y en otros centros ha demostrado que tales inmunocitos efectivamente llegan a los tumores cerebrales, lo cual convierte a la inmunoterapia en una opción. “Se ha demostrado que la inflamación del cerebro puede abrir la barrera hematoencefálica para que los inmunocitos puedan ingresar al parénquima cerebral”, dijo el Dr. Tomasz Zal, Ph.D., profesor asociado del Departamento de Inmunología.
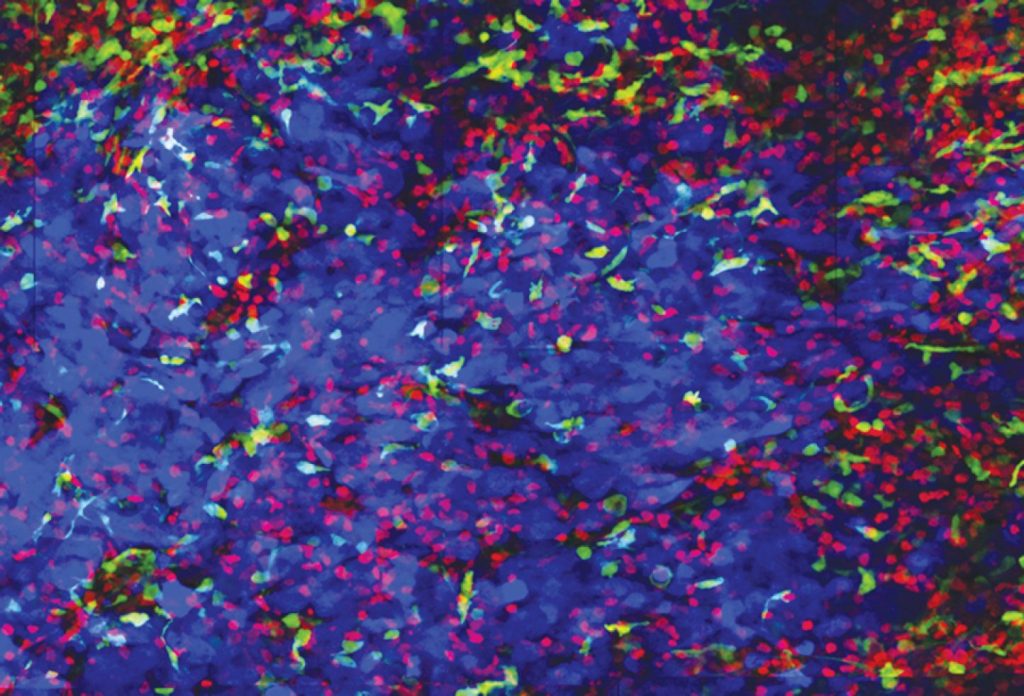
El laboratorio del Dr. Zal es uno de los primeros del mundo en utilizar microscopía de dos fotones, la cual permite a los investigadores visualizar células situadas a profundidad en el tejido vivo mediante tinción fluorescente. El Dr. Zal y sus colegas utilizan esta tecnología para estudiar la formación del tumor y la respuesta inmunitaria en los cerebros de ratones vivos.
“Comprender los mecanismos de la respuesta inmunitaria puede ayudarnos a programar dosis de inmunoterapia”, dijo el Dr. Zal. “El tiempo es un factor crítico en la inmunoterapia: todo depende de cuándo los inmunocitos son reclutados en el tumor”. Agregó que la estrecha colaboración existente entre los profesionales clínicos y los científicos básicos del MD Anderson les permite explorar múltiples abordajes de la inmunoterapia.
Cuando es posible, los profesionales clínicos prefieren comenzar el régimen inmunoterapéutico de un paciente tan pronto como se identifica el glioblastoma, y antes de la resección. Cuando la inmunoterapia se administra durante esta “ventana de oportunidad” en los ensayos clínicos, los efectos del tratamiento se estudian en la muestra quirúrgica en el momento de la resección.
“Estos ensayos en la ventana de oportunidad nos permiten administrar una inmunoterapia y determinar si un número suficiente de inmunocitos están en tránsito hacia el tumor y si esos inmunocitos son funcionalmente capaces de matar el cáncer”, dijo la Dra. Heimberger. “Estos ensayos están comenzando a revelar secretos del microambiente del tumor y pueden ayudarnos a identificar estrategias que podrían mejorar la respuesta inmunitaria”. El concepto “ventana de oportunidad” es explotado en dos ensayos que actualmente están inscribiendo a pacientes con glioblastoma en el MD Anderson: uno en el cual los pacientes reciben un inhibidor de puntos de control inmunitario y otro en el que reciben células T modificadas autólogas.
Pembrolizumab
“En uno de los ensayos más prometedores de nuestra cartera de inmunoterapia, los pacientes con glioblastoma recurrente reciben un inhibidor de puntos de control antes de someterse a cirugía”, dijo el Dr. de Groot. En este ensayo clínico (N.º 2014-0820), los pacientes reciben dos dosis del inhibidor PD-1 (proteína de muerte celular programada 1) pembrolizumab antes de la cirugía. Los pacientes continúan recibiendo el fármaco después de la cirugía hasta la progresión de la enfermedad o hasta que ocurren efectos tóxicos inaceptables.
La Dra. Heimberger, uno de los investigadores principales conjuntos del ensayo junto con el Dr. de Groot, dijo: “Creo que en este ensayo habrá un subgrupo de pacientes que responderán a la monoterapia con un inhibidor de puntos de control inmunitario, pero es probable que una combinación terapéutica que mejore los blancos inmunitarios, la activación inmunitaria y el tránsito de los inmunocitos a los tumores, será lo que mejor funcione para nuestros futuros pacientes”.
Terapia adoptiva de células T
Otro ensayo en curso (N.º 2014-0899) utiliza células T autólogas específicas para citomegalovirus. “Casi todos sufren infección por citomegalovirus durante su vida, y existe una posible asociación entre el virus y el glioblastoma”, dijo la Dra. Heimberger. Agregó que si bien no está claro si el citomegalovirus cumple una función en la formación del glioblastoma, se sabe que antígenos específicos para el citomegalovirus como CMV pp65 son expresados en el glioblastoma.
La investigación liderada por las Dras. Elizabeth Shpall y Katy Rezvani, Ph.D., ambas profesoras del Departamento de Trasplante de Células Madre y Terapia Celular, demostró que las células T específicas para citomegalovirus pueden desplazarse al tejido tumoral pero una gran proporción de la función efectora de las células T se ve suprimida. Los investigadores desarrollaron entonces una estrategia para expandir rápidamente células T polifuncionales, altamente citotóxicas, específicas para el virus. Esas células T se utilizan en el ensayo en curso.
El ensayo, conducido por la Dra. Marta Penas-Prado, profesora adjunta del Departamento de Neurooncología, tiene dos grupos de tratamiento en su fase II: uno en el cual pacientes con glioblastoma recurrente inician la terapia con células T antes de la cirugía y otro en el cual pacientes con glioblastoma recientemente diagnosticado inician la terapia con células T después de la cirugía y la radioterapia. En ambos grupos, se extraen células T de los pacientes mediante leucaféresis. Las células T de cada paciente se cultivan con CMV pp65 y se expanden en el Centro de Buenas Prácticas de Fabricación y Terapia Celular del MD Anderson, que es dirigido por las Dras. Shpall y Rezvani.
Después de la leucaféresis, los pacientes de ambos grupos de tratamiento reciben temozolomida de dosis densa durante los primeros 21 días del ciclo de 42 días. En el día 22, los pacientes reciben su primera infusión de células T autólogas específicas para citomegalovirus. En el caso de los pacientes con glioblastoma recurrente, la resección se lleva a cabo el día 30. Los pacientes en ambos grupos de tratamiento continúan recibiendo temozolomida de dosis densa e infusiones de células T por un total de cuatro ciclos de 42 días, a lo cual sigue una monoterapia de dosis estándar de temozolomida hasta que se produce la progresión de la enfermedad u ocurren efectos tóxicos inaceptables.
“La temozolomida es el tratamiento habitual, y si este se programa con precisión—se administra la quimioterapia y luego la inmunoterapia—se obtiene una respuesta inmunitaria expandida”, dijo la Dra. Heimberger. De manera similar al ensayo de pembrolizumab, el análisis de los tumores resecados después del tratamiento con temozolomida y células T modificadas ayudará a la Dra. Heimberger y sus colegas a cuantificar la magnitud de esa respuesta inmunitaria y determinar si dicha respuesta inmunitaria corresponde a la respuesta al tratamiento.
Células NK
Las células NK alogénicas de sangre de cordón umbilical representan una atractiva opción de inmunoterapia por varias razones. En primer lugar, a diferencia de las células T, las células NK no requieren un antígeno específico para la activación. En segundo lugar, las células NK alogénicas pueden producir un efecto injerto contra tumor sin causar enfermedad injerto contra huésped. Además, las células NK de sangre de cordón pueden almacenarse como un tratamiento listo para usar y su seguridad se ha visto demostrada en ensayos clínicos para pacientes con mieloma, linfoma y leucemia.
Antes de que los investigadores pudieran designar un ensayo clínico de células NK derivadas de sangre de cordón umbilical en pacientes con glioblastoma, era necesario saber si las propias células NK de los pacientes con glioblastoma se desplazaban a los tumores. Las Dras. Rezvani y Heimberger estudiaron las células NK en muestras de glioblastomas resecados y comprobaron que esas células llegan a los tumores pero pierden su funcionalidad en el microambiente del tumor.
La Dra. Rezvani y su grupo llevaron a cabo estudios in vitro para encontrar la razón de la disfunción de las células NK. “Cuando cultivamos células NK de sangre de cordón umbilical sanas junto con células de glioblastoma, al principio las células NK se mostraron activas”, dijo la Dra. Rezvani. “Sin embargo, poco después las células del glioblastoma indujeron la disfunción en las células NK y esta disfunción fue mediada por el factor de crecimiento tumoral [TGF]-β”. Asimismo, los investigadores comprobaron que la inhibición de este prevenía la disfunción de las células NK inducida por el glioblastoma.
Como resultado de estos hallazgos, se espera que más adelante en este año se abra un ensayo clínico de células NK de sangre de cordón umbilical combinadas con un inhibidor de TGF-β para pacientes con glioblastoma. La Dra. Penas-Prado será la investigadora principal. Las células NK para el ensayo se expandirán en el Centro de Buenas Prácticas de Fabricación y Terapia Celular a partir de unidades de sangre de cordón umbilical provistas por el banco de sangre de cordón umbilical del MD Anderson, que es dirigido por la Dra. Shpall.
Otra investigación
En otro ensayo que—según lo esperado—se abrirá muy pronto, pacientes con glioblastoma recibirán WP1066, un inhibidor de STAT3 desarrollado en el MD Anderson por el Dr. Waldemar Priebe, Ph.D., profesor del Departamento de Terapéutica Experimental. “Este fármaco puede traspasar la barrera hematoencefálica y tiene actividad contra el cáncer mismo así como actividad inmunológica”, dijo la Dra. Heimberg, la investigadora principal del ensayo. “Casi todos los mecanismos de supresión inmunitaria mediada por el tumor se vinculan con STAT3”.
Además de ser elegibles para los ensayos de inmunoterapia específicos para los pacientes con tumores cerebrales, los pacientes con glioblastoma suelen ser elegibles para recibir nuevos agentes inmunoterapéuticos en ensayos clínicos que se abren para pacientes con cualquier tipo de tumor sólido a través del Departamento de Investigación de Tratamientos contra el Cáncer. “Estos ensayos que están abiertos para pacientes con todo tipo de tumores son una buena oportunidad para nuestros pacientes”, dijo el Dr. de Groot. “Y, a veces, los resultados de esos ensayos nos llevarán hacia el desarrollo de un agente específicamente para los pacientes con glioblastoma”.
El Dr. de Groot y sus colegas esperan que su investigación aclare la función de la inmunoterapia en el tratamiento multimodal del glioblastoma y, en última instancia, extienda la supervivencia de sus pacientes.